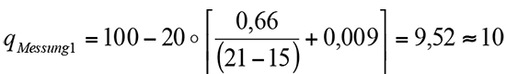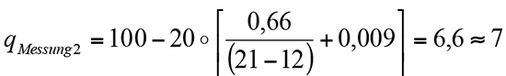Dabei ist Lambda, so spricht man diesen griechischen Buchstaben, nämlich wirklich durchschaubar. Wir besprechen übrigens in diesem Bericht Lambda als Luftverhältniszahl und zwar im Zusammenhang mit der Verbrennungstechnik. Das Zeichen und damit der Lambda-Wert taucht auch im Zusammenhang mit der Wärmeleitfähigkeit eines Stoffes auf wie beispielsweise bei einer Dämmung.
Aber hier geht es um Verbrennungsvorgänge.
Grundgedanke
Zur Verbrennung fossiler Brennstoffe setzen wir in der Regel den Sauerstoff aus der Luft ein. Im folgenden Beispiel soll die Verbrennung von reinem Methan beschrieben werden. Dieser Vorgang soll im Zusammenhang mit Lambda das Verständnis ermöglichen. Dazu werden zuerst einmal Fakten zusammengetragen:
Die brennbaren Bestandteile für den Wärmeenergie spendenden Vorgang der Verbrennung sind im Methan der gasförmige Kohlenstoff und Wasserstoff. Wärmeenergie spendend kann man übrigens in einem Gespräch unter Kollegen abkürzen mit dem Fachbegriff „exotherm“. Das macht schon mal einen sehr schlanken Fuß!
Die Formel von Methan ist CH4 und meint also, dass Methan ein Molekül ist aus einem Kohlenstoff-Atom [C] und vier Wasserstoff-Atomen [H4].
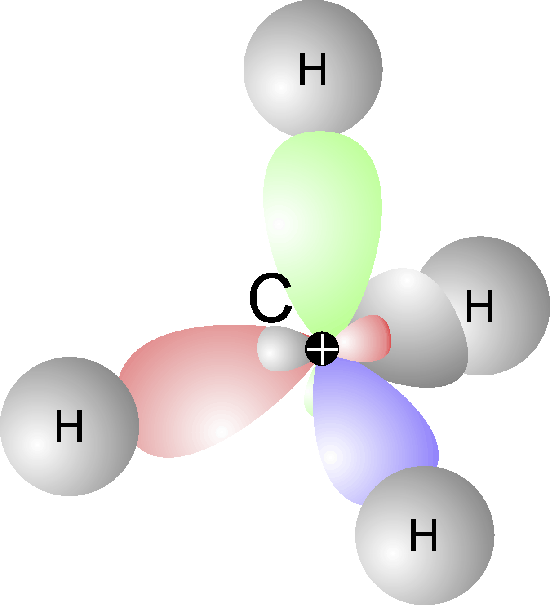
Diese Konstellation funktioniert sehr gut, weil Kohlenstoff gewissermaßen 4 Ärmchen besitzt und Wasserstoff jeweils nur 1 Ärmchen. Füchse sprechen auch vom einwertigen Wasserstoff [H] und vierwertigen Kohlenstoff [C].
Um diesen Club aufzulösen, bedarf es eines reaktionsfreudigen Stoffes wie etwa Sauerstoff [O]. Zusätzlich braucht man einen Zündfunken, also gewissermaßen eine Initialzündung. Dann läuft das Aufspalten von dem Kohlenwasserstoff-Clübchen zu einer neuen Verbindung unter Abgabe von Wärme immer weiter, bis eventuell einer der Stoffe nicht mehr in ausreichender Menge zur Verfügung steht.
Die gasförmigen Kohlenwasserstoffe und der Luftsauerstoff setzen sich also neu zusammen. Dabei entsteht im besten Fall immer Wasser [H2O] und Kohlendioxid [CO2] .
Sie merken schon den beiden Molekül-Formeln von Wasser und Kohlendioxid an, dass sämtliche Ausgangsstoffe wieder beteiligt sind. Wie sollte es auch anders sein.
Für die Bildung von Wasser haben sich zwei einwertige H-Atome mit einem Sauerstoff-Atom verbunden. Sauerstoff ist, wie Sie schon richtig vermuten, zweiwertig.
Für die Bildung von Kohlendioxid hat sich der vierwertige Kohlenstoff mit zwei zweiwertigen Sauerstoffatomen verbunden.
Diese beiden Produkte, also Wasser und Kohlendioxid, sind stabil. Um noch mal auf das Bild mit den Ärmchen zurückzukommen, kann man den jeweiligen Verbrennungsprodukten bescheinigen, dass jedes Ärmchen, das gierig nach einem anderen Ärmchen sucht, seinen Partner gefunden hat.
Um schon mal vorweg etwas klarzustellen: Sollte beispielsweise nicht genug Sauerstoff vorhanden sein, so kann es auch durchaus vorkommen, dass der Prozess der Verbrennung gewissermaßen hängen bleibt. Dann entsteht statt Kohlendioxid nur das giftige Kohlenmonoxid [CO]. An der Formel und zusammen mit dem Bild der Ärmchen wird klar, dass da zwei Kohlenstoff-Ärmchen noch gierig fischen nach einem weiteren Sauerstoff-Atom. Einerseits ist Kohlenmonoxid also noch brennbar und andererseits fischt es gierig nach dem fehlenden Sauerstoffatom. Im Zweifel fischt es in der Lunge eines Menschen, was tödlich sein kann.
Übrigens holt man sich Sauerstoff bei der Verbrennung in einem konventionellen Heizkessel immer aus der Umgebungsluft. In der Umgebungsluft ist ein Anteil von 21 Prozent Sauerstoff. Um einen Kubikmeter Sauerstoff zu bekommen, muss man sich daher auch mit 3,76 Kubikmeter Stickstoff abfinden. Nachrechnen kann man das mit dem Ansatz 79/21 = 3,76.
DICTIONARY
Abgas = exhaust
Luftsauerstoff = aerial oxygen
Gleichung = equation
Maximalwert = maximum value
Wissenschaftliche Betrachtung
In einer wissenschaftlichen Betrachtung stellt man eine Gleichung auf und redet nicht von Ärmchen, die gierig winken (das kann nämlich zu traumatischen Angstzuständen führen, wenn man sich so etwas während des Kundendiensteinsatzes vorstellt).
Die sogenannte Stöchiometrie stellt die Grundlage für eine solche Verbrennungsreaktion:
Umgangssprachlich sagt man also
Methan plus Luft reagiert zu Kohlendioxid plus Wasser plus Stickstoff
Methan ist chemisch CH4
Sauerstoff ist O2
Stickstoff ist N2
Kohlendioxid ist CO2
Wasser ist H2O
CH4 + O2 + 3,76 N2 = CO2 + H2O + 3,76 x N2
Bei einer Gleichung steht rechts und links das Gleiche, daher der sinnige Name Gleichung. In der oben stehenden Gleichung ist das aber noch nicht der Fall. Zum Beispiel sind links vier Wasserstoffatome (H4) und rechts nur zwei (H2O). Man ergänzt also auf beiden Seiten so lange, bis jeweils gleiche Anteile stehen.
CH4 + 2 x O2 + 2 x 3,76 x N2 = CO2 + 2 x H2O + 2 x 3,76 x N2
oder weiter gekürzt
CH4 + 2O2 + 7,52 N2 = CO2 + 2H2O + 7,52 N2
Dann steht dort nach ausgeklügelter Gleichung und wieder für den verbrennungstechnischen Laien aufbereitet:
Wenn 1 Kubikmeter Methan verbrannt werden soll, dann benötigt man dazu 2 Kubikmeter Sauerstoff. Den Sauerstoff kriegt man aber nur, wenn man 7,52 Kubikmeter Stickstoff ebenfalls aus der Umgebungsluft mit einströmen lässt.
Als Verbrennungsprodukte entstehen dabei 1 Kubikmeter Kohlendioxid plus 2 Kubikmeter dampfförmiges Wassers plus 7,52 Kubikmeter Stickstoff.
Auf diese Weise kann man für Methan als Brennstoff den maximalen CO2-Anteil im Abgas voraussagen. Bezogen wird dieser Wert normalerweise auf das trockene Abgas, also ohne den Anteil von Wasserdampf.
Ein Kubikmeter CO2 plus 7,52 Kubikmeter N2 ergibt zusammen 8,52 m³ Abgas.
Umgangssprachlich kann man also nach dieser stöchiometrischen Gleichung behaupten, dass man bei der Verbrennung von 1 Kubikmeter Methan im besten Fall 8,52 Kubikmeter trockenes Abgas erhält. Darin steckt wiederum 1 Kubikmeter
Kohlendioxid und das macht einen Anteil aus, der sich sehr leicht berechnen lässt, denn:
1 / 8,52 = 11,7
Hier wurde also soeben nachgewiesen:
Bei einer stöchiometrischen Verbrennung von Methan entstehen 11,7 Prozent Kohlendioxid im trockenen Abgas. Das entspricht den Tabellenwerten von Lehr- und Tabellenbüchern.
Wenn sie jetzt annehmen, dass das ein sehr theoretischer Wert ist, dann haben Sie ganz sicher Recht. Aber Sie können gedanklich einige weitere Erkenntnisse daraus ziehen.

Erkenntnisse für die Praxis
Das soeben errechnete Ergebnis stellt einen Idealfall dar. Jedes Kohlen- und Wasserstoff-Atom hat sein zugehöriges Sauerstoff-Atom bekommen. Die Gleichung ging super auf. Leider lässt sich dieser Idealfall nicht in realen Verbrennungsprozessen umsetzen. Die Wirklichkeit sieht anders aus.
Schickt man exakt die Luftmenge ins Rennen, die unbedingt notwendig ist, um diesen skizzierten Verbrennungsprozess ablaufen zu lassen, sind leider die Ergebnisse unbefriedigend. Es ist tatsächlich so, dass man keine ausreichende Durchmischung hinbekommt die bei einer stöchiometrischen Verbrennung angedacht ist. Faktisch bliebe ein Teil der Kohlenstoffatome auf der Strecke und dabei würde sich das so verhasste Kohlenmonoxid bilden, statt des gewünschten Kohlendioxids. Es wird in der Realität also mehr Luft zugegeben als eigentlich benötigt würde. Die Gewissheit, dass dann aber jedem Kohlenstoff-Atom zwei Sauerstoff-Atome ins Ärmchen getrieben werden ist es letztlich wert, diese Verschwendung so einzugehen.
Sie fragen sich jetzt, warum man das eine Verschwendung sein soll?
Weil mit jedem eigentlich unnötigen Liter zusätzlichen Sauerstoff ja auch 3,76 zusätzliche Liter Stickstoff angesaugt werden. Der Stickstoff bleibt nicht kalt, sondern wird ebenso wie das übrige Abgas aufgeheizt und ins Freie geblasen.
Kurz und knapp kann man sagen: Eigentlich sollte nur die unbedingt notwendige Luftmenge zur Verbrennung bereitgestellt werden. Praktisch muss dieser Anteil aber immer etwas höher liegen.
FILM ZUM THEMA
Einen Film des Messgeräteherstellers Wöhler zur Messung von Abgasmessung gibt es hier:
www.sbz-monteur.de ➔ Das Heft ➔ Filme zum Heft
Konsequenzen für die Praxis
Zwei Szenarien kann man gedanklich ganz gut überprüfen:
Was passiert mit den Messwerten für CO2 beziehungsweise für CO bei Überschreitung der notwendigen Luftzufuhr und was bei Unterschreitung?
Zuerst einmal gilt: Wenn Sie dem Bericht folgen konnten, sind Sie offizieller Lambda-Kenner. Ist nämlich die Luftzufuhr bei der Verbrennung exakt auf den stöchiometrischen Wert eingestellt, handelt es sich um den Lambda-Wert 1. Wird mehr Luft zugegeben als eigentlich notwendig, handelt es sich um einen Lambda-Wert größer 1. Wird sogar mit Luftmangel gearbeitet, ist der Lambda-Wert kleiner 1.
Wird also exakt die Luftmenge zugegeben, die eine Verbrennung theoretisch benötigen würde, könnte sich wegen der unvollständigen Vermischung von Luft und Brennstoff leider auch etwas CO bilden. Der Maximalwert für CO2 lässt sich so also in der Praxis nicht erreichen. Lieber akzeptiert man in der Praxis einen Luftüberschuss und damit einen Lambda-Wert größer 1, um auf diese Weise dem Manko der CO-Bildung durch immer mehr Sauerstoffüberschuss begegnen zu können. Auf diese Weise korrigiert man insgesamt die Abgasverluste nach unten. Man nimmt in Kauf, dass überschüssige Luft und Sauerstoffmengen durch den Schornstein geblasen werden. Aber dafür wird der eingesetzte Brennstoff zu einem erheblichen Anteil komplett ausgenutzt.
Der springende Punkt ist aber:
Man erkauft sich den hohen Anteil der Verwandlung von Kohlenstoff zu Kohlendioxid durch immer mehr Abgasmenge insgesamt. Das bedeutet, dass prozentual der Anteil an CO2 im Abgas sogar sinkt, obwohl absolut mehr CO2 im Abgas enthalten ist. Auf Basis dieser Überlegungen erforschten die Hersteller von Wärmeerzeugern oder Brennern immer neue Techniken zur optimalen Verbrennung fossiler Brennstoffe. Heraus kamen zur Verbrennung von Erdgas die anspruchslosen, atmosphärischen Brenner mit Rückstromsicherung. Es sind hervorragende, aber technisch etwas aufwendigere Gebläsebrenner am Markt etabliert, die der Gemischaufbereitung ein ordentliches Gebläse spendiert haben. Diese kommen ohne Rückströmsicherung aus und pressen das Abgas gewissermaßen gewaltsam nach draußen. Heutzutage sind die sogenannten Vormischbrenner verbreitet. Sie arbeiten ebenso gebläseunterstützt und erreichen sehr hohe CO2-Gehalte im Abgas.
Die effiziente Verbrennung von Heizöl gestaltet sich ungleich schwieriger. Zurzeit ist noch der Zerstäuberbrenner der am häufigsten verwendete. Schwieriger ist die Verbrennung im Vergleich zum Erdgas, weil ja der Brennstoff Öl an sich erst einmal in die gasförmige Phase überführt werden muss, um überhaupt eine Neigung zu zeigen, sich mit Sauerstoff zu verbinden.
Lehrsatz zu Lambda: Das Verhältnis der überschüssigen Verbrennungsluft zum theoretischen Luftbedarf nennt man Luftzahl oder Luftverhältniszahl λ (Lambda).
Messtechnische Erfassung
Die Abgas-Messgeräte im Kundendiensteinsatz unserer SHK-Branche erfassen diese Zusammenhänge. Das bedeutet, dass in diesen Geräten der Sauerstoffgehalt des Abgases gemessen und dann hochgerechnet wird. Das Messgerät schließt gewissermaßen vom Sauerstoffgehalt im Abgas auf den Kohlendioxidgehalt.
Erfahrene Kundendienstmonteure stellen den herstellerspezifischen Wert für eine optimale Verbrennung des jeweiligen Wärmeerzeugers ein. Sie wissen spätestens seit diesem Bericht, warum nicht ein theoretischer Maximalwert in Abhängigkeit von dem eingesetzten Brennstoff das Ziel einer Einstellung ist.
CO2max
Heizöl: 15,4 %
Erdgas: 11,9 %
Methan: 11,7 %
Flüssiggas: 13,9 %
Vielmehr muss die Art der Gemischaufbereitung des Brennstoffs und der Umgebungsluft berücksichtigt werden.
Jeder Hersteller von Wärmeerzeugern hat da seine eigenen Spitzenwerte.
Ein empfindlicher CO-Sensor eines Abgasmessgerätes gibt bei Bedarf eine Auskunft über den Anteil des schädlichen, weil giftigen Kohlenmonoxids. CO im Abgas ist natürlich auch ein Indiz für eine unvollständige Verbrennung.
Und der Wirkungsgrad?
Ziel der Einstellungen an einem Brenner ist es also, den herstellerspezifisch kleinsten Wert des Sauerstoffgehaltes und damit den höchsten Wert für CO2-Anteile im Abgas einzustellen. Das entspricht dann gleichzeitig dem kleinsten einstellbaren Lambda-Wert für diese Feuerung. Das ist kein Selbstzweck, sondern stellt in der Regel die höchste Effizienz für diese Feuerung dar.
Ein modernes Messgerät ermittelt aus diesen Messdaten dann die Abgasverluste der gesamten Anlage. Es fehlen allerdings noch die Temperaturen der Verbrennungsluft und des Abgases. Es versteht sich von selbst, dass mit Abgasen, die extrem heiß ins Freie geblasen werden, kein hoher Wirkungsgrad zu erzielen ist.
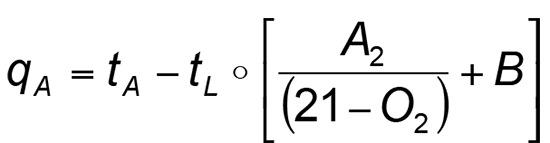
Formelkürzel:
tA: Abgas-Temperatur
tL: Verbrennungsluft-Temperatur
A2/B: brennstoffspezifische Faktoren (siehe Tabelle)
21: Sauerstoffgehalt der Luft
O2: gemessener O2-Wert
Tabelle der brennstoffspezifischen Faktoren (Auszug)
Überprüft man anhand dieser Formel den Zusammenhang von Sauerstoffgehalt im Abgas auf den Wirkungsgrad, so zeigt sich bei ansonsten gleichen Temperaturverhältnissen die bereits beschriebene Abhängigkeit. Viel Sauerstoff im Abgas deutet auf eine weniger effiziente Verbrennung hin.
Beispiel:
Feste Werte für:
Verbrennung von Erdgas
tA = 100
tL = 20
Variable Werte für den Anteil von Sauerstoff mit
Messung 1: 15 % Sauerstoff
Messung 2: 12 % Sauerstoff