Dabei ist Lambda, so spricht man diesen griechischen Buchstaben aus, eine wichtige Größe in unserer Fachsprache. Wir besprechen übrigens in diesem Bericht Lambda als Luftverhältniszahl und im Zusammenhang mit der Verbrennungstechnik. Das Zeichen und damit der Lambda-Wert taucht auch auf im Zusammenhang mit der Wärmeleitfähigkeit eines Stoffes wie beispielsweise einer Dämmung. Aber hier geht es um Verbrennungsvorgänge.
Grundgedanke
Zur Verbrennung fossiler Brennstoffe setzen wir in der Regel den Sauerstoff aus der Luft ein. Im folgenden Beispiel soll die Verbrennung von reinem Methan beschrieben werden. Dieser Vorgang soll im Zusammenhang mit Lambda das Verständnis ermöglichen. Dazu werden zuerst einmal Fakten zusammengetragen:
Die brennbaren Bestandteile für den wärmeenergiespendenden Vorgang der Verbrennung sind im Methan die zu einem Molekül verbundenen Elemente Kohlenstoff und Wasserstoff. Wärmeenergiespendend kann man übrigens in einem Gespräch unter Kollegen abkürzen mit dem Fachbegriff „exotherm“. Man spricht dann von einer exothermen Reaktion. Das macht einen sehr schlanken Fuß!
Die Formel von Methan ist CH4 und meint also, dass Methan ein Molekül ist aus einem Kohlenstoff-Atom [C] und vier Wasserstoff-Atomen [H4]
Diese Konstellation funktioniert sehr gut, weil Kohlenstoff gewissermaßen 4 Ärmchen besitzt und Wasserstoff jeweils nur 1 Ärmchen. Füchse sprechen auch vom einwertigen Wasserstoff [H] und vierwertigen Kohlenstoff [C].
Um diesen Kohlenwasserstoff-Club aufzulösen bedarf es eines reaktionsfreudigen Stoffes wie etwa Sauerstoff [O]. Zusätzlich braucht man einen Funken als Initialzündung. Dann läuft das Aufspalten dieses Kohlenwasserstoff-Clübchens zu einer neuen Verbindung unter Abgabe von Wärme immer weiter, bis eventuell einer der Stoffe nicht mehr in ausreichender Menge zur Verfügung steht.
Die Kohlenwasserstoffe und der Luftsauerstoff setzen sich also beim Verbrennen neu zusammen. Dabei entsteht im besten Fall immer Wasser [H2O] und Kohlendioxid [CO2].
Sie merken schon den beiden Molekül-Formeln von Wasser und Kohlendioxid an, dass sämtliche Ausgangsstoffe wieder beteiligt sind. Wie sollte es auch anders sein?
Für die Bildung von Wasser haben sich zwei einwertige H-Atome (Klar, immer noch einwertig!) mit einem Sauerstoff-Atom verbunden. Sauerstoff ist, wie Sie schon richtig vermuten, zweiwertig.
Für die Bildung von Kohlendioxid hat sich der vierwertige Kohlenstoff mit zwei zweiwertigen Sauerstoffatomen verbunden.
Diese beiden Produkte, also Wasser und Kohlendioxid, sind stabil. Um noch mal auf das Bild mit den Ärmchen zurückzukommen, kann man den jeweiligen Verbrennungsprodukten bescheinigen, dass jedes Ärmchen, das gierig nach einem anderen Ärmchen sucht, seinen Partner gefunden hat.
Und, um schon mal vorweg etwas klarzustellen: Sollte beispielsweise nicht genug Sauerstoff vorhanden sein, so kann es auch durchaus vorkommen, dass der Prozess der Verbrennung gewissermaßen hängenbleibt. Dann entsteht statt Kohlendioxid nur das giftige Kohlenmonoxid [CO]. An der Formel und zusammen mit dem Bild der Ärmchen wird klar, dass da zwei Kohlenstoff-Ärmchen noch gierig fischen nach einem weiteren Sauerstoff-Atom. Einerseits ist Kohlenmonoxid also noch brennbar und andererseits fischt es gierig nach dem fehlenden Sauerstoffatom. Im Zweifel fischt es in der Lunge eines Menschen, was tödlich sein kann.
Übrigens holt man sich Sauerstoff bei der Verbrennung in einem konventionellen Heizkessel immer aus der Umgebungsluft. In der Umgebungsluft ist ein Anteil von 21 Prozent Sauerstoff. Um einen Kubikmeter Sauerstoff zu bekommen, muss man sich daher auch mit 3,76 Kubikmeter Stickstoff abfinden. Nachrechnen kann man das mit dem mathematischen Ansatz 79/21 = 3,76.
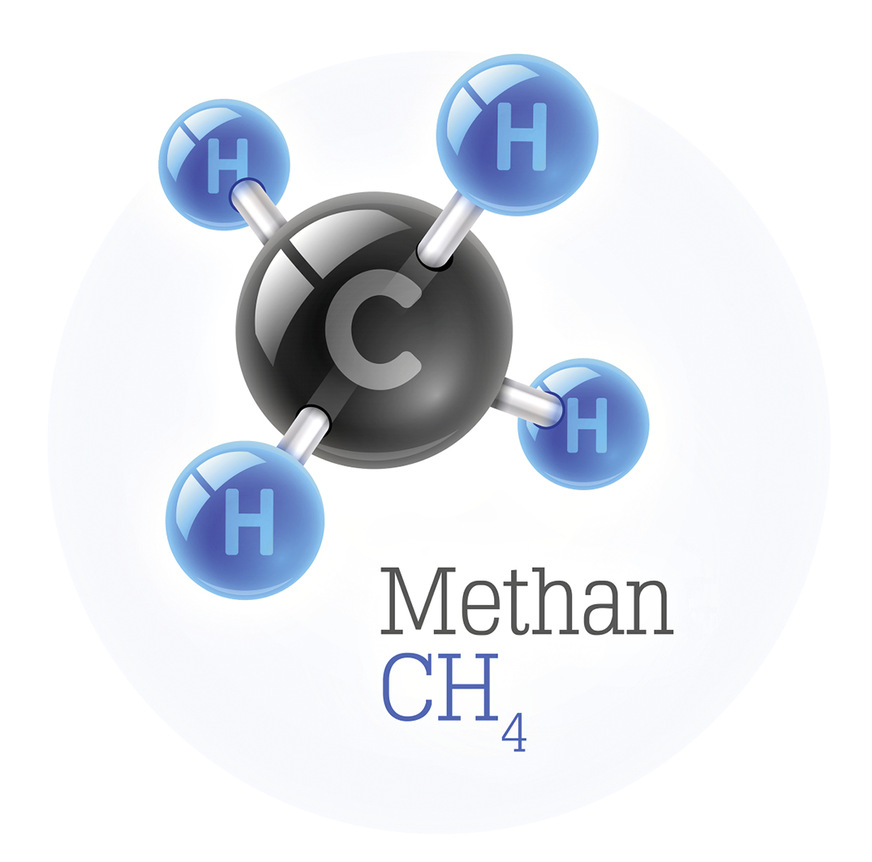
Bild: LoopAll – stock.adobe.com
Wissenschaftliche Betrachtung
In einer wissenschaftlichen Betrachtung stellt man eine Gleichung auf und redet nicht von Ärmchen, die gierig winkend einen Partner suchen. Das kann nämlich zu traumatischen Angstzuständen führen, wenn man sich so etwas während des Kundendiensteinsatzes einsam in einem Heizungskeller vorstellt.
Die sogenannte Stöchiometrie stellt die Grundlage für eine solche Verbrennungsreaktion:
Umgangssprachlich sagt man also
Methan plus Luft reagiert in einer exothermen Reaktion zu Kohlendioxid plus Wasser plus Stickstoff
Methan ist chemisch CH4
Sauerstoff ist O2
Stickstoff ist N2
Kohlendioxid ist CO2
Wasser ist H2O
CH4 + O2 + 3,76 N2 = CO2 + H2O + 3,76 N2
Bei einer Gleichung steht rechts und links das Gleiche, daher der sinnige Name Gleichung. In der obenstehenden Gleichung ist das aber noch nicht der Fall. Zum Beispiel sind links vier Wasserstoffatome (H4) und rechts nur zwei (H2O). Man ergänzt also auf beiden Seiten solange, bis jeweils gleiche Anteile stehen.
CH4 + 2 • O2 + 2 • 3,76 N2 = CO2 + 2 • H2O + 2 • 3,76 N2
oder weiter gekürzt
CH4 + 2O2 + 7,52 N2 = CO2 + 2H2O + 7,52 N2
Dann steht dort nach ausgeklügelter Gleichung und wieder als Umgangssprache aufbereitet:
Wenn 1 Kubikmeter Methan verbrannt werden soll, dann benötigt man dazu 2 Kubikmeter Sauerstoff. Den Sauerstoff kriegt man aber nur, wenn man 7,52 Kubikmeter Stickstoff ebenfalls aus der Umgebungsluft mit in den Brennraum einströmen lässt.
Als Verbrennungsprodukte entstehen dabei 1 Kubikmeter Kohlendioxid plus 2 Kubikmeter dampfförmiges Wasser plus 7,52 Kubikmeter Stickstoff.
Auf diese Weise kann man für Methan als Brennstoff den maximalen CO2-Anteil im Abgas voraussagen. Bezogen wird dieser Wert normalerweise auf das trockene Abgas, also ohne den Anteil von Wasserdampf.
Ein Kubikmeter CO2 plus 7,52 Kubikmeter N2 ergibt zusammen 8,52 m³ Abgas.
Umgangssprachlich kann man also nach dieser stöchiometrischen Gleichung behaupten, dass man bei der Verbrennung von 1 Kubikmeter Methan im besten Fall 8,52 Kubikmeter trockenes Abgas erhält. Darin steckt wiederum 1 Kubikmeter Kohlendioxid, und das macht einen Anteil aus, der sich sehr leicht berechnen lässt, denn:
1 / 8,52 = 0.117 oder eben 11,7 %
Hier wurde also soeben nachgewiesen:
Bei einer stöchiometrischen Verbrennung von Methan entstehen 11,7 % Kohlendioxid im trockenen Abgas. Das entspricht den Angaben von Lehr- und Tabellenbüchern.
Wenn sie jetzt annehmen, dass das ein sehr theoretischer Wert ist, dann haben Sie ganz sicher Recht. Aber Sie können gedanklich einige weitere Erkenntnisse daraus ziehen.
Erkenntnisse für die Praxis
Das soeben errechnete Ergebnis stellt einen Idealfall dar. Jedes Kohlenstoff- und Wasserstoff-Atom hat sein zugehöriges Sauerstoff-Atom bekommen. Die Gleichung ging super auf. Leider lässt sich dieser Idealfall nicht in realen Verbrennungsprozessen umsetzen. Die Wirklichkeit sieht etwas anders aus.
Schickt man exakte die Luftmenge ins Rennen, die unbedingt notwendig ist, um diesen skizzierten Verbrennungsprozess ablaufen zu lassen, sind leider die Ergebnisse unbefriedigend. Es ist tatsächlich so, dass man keine ausreichende Durchmischung realisieren kann, die bei einer stöchiometrischen Verbrennung angedacht ist. Faktisch bliebe ein Teil der Kohlenstoffatome auf der Strecke, und dabei würde sich das so verhasste Kohlenmonoxid bilden statt des gewünschten Kohlendioxids. Es wird in der Realität also mehr Luft zugegeben als eigentlich benötigt würde. Die Gewissheit, dass dann aber jedem Kohlenstoff-Atom zwei Sauerstoff-Atome in die Ärmchen getrieben werden, ist es letztlich wert, diese Verschwendung so einzugehen.
Sie fragen sich jetzt, warum das eine Verschwendung sein soll?
Weil mit jedem eigentlich unnötigen Liter zusätzlichem Sauerstoff ja auch 3,76 zusätzliche Liter Stickstoff angesaugt werden. Der Stickstoff bleibt nicht kalt, sondern wird ebenso wie das übrige Abgas aufgeheizt und ins Freie geblasen.
Kurz und knapp kann man sagen: Eigentlich sollte nur die unbedingt notwendige Luftmenge zur Verbrennung bereitgestellt werden. Praktisch muss dieser Anteil aber immer etwas höher liegen, damit der Verbrennungsprozess umfassend abläuft.
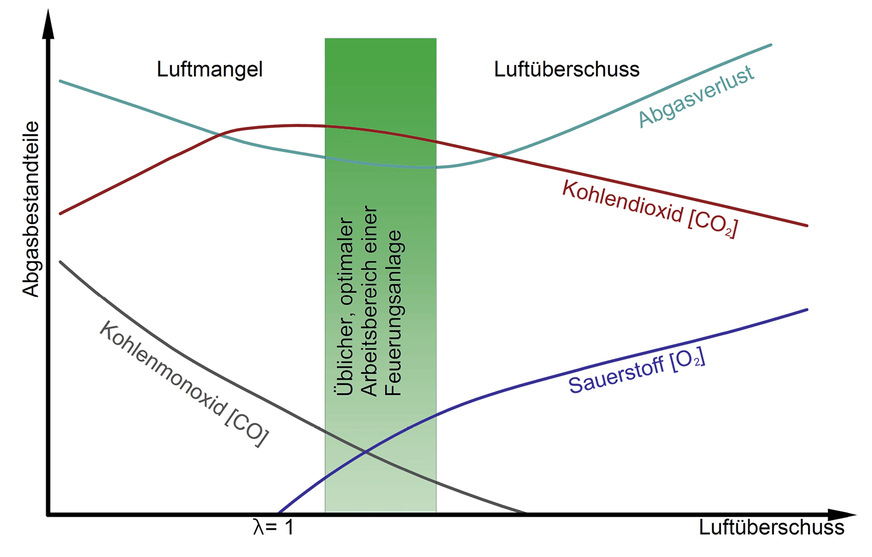
Bild: IBH
Konsequenzen für die Praxis
Zwei Szenarien kann man gedanklich ganz gut überprüfen:
Was passiert mit den Messwerten für CO2 beziehungsweise für CO bei Überschreitung der notwendigen Luftzufuhr und was bei Unterschreitung?
Zuerst einmal gilt: Wenn Sie dem Bericht bis hierher folgen konnten, sind Sie offizieller Lambda-Kenner. Ist nämlich die Luftzufuhr bei der Verbrennung exakt auf den stöchiometrischen Wert eingestellt, handelt es sich um den Lambda-Wert 1. Wird mehr Luft zugegeben als eigentlich notwendig, handelt es sich um einen Lambda-Wert größer 1. Wird sogar mit Luftmangel gearbeitet, ist der Lambda-Wert kleiner 1.

Wird also exakt die Luftmenge zugegeben, die eine Verbrennung theoretisch benötigt, würde sich wegen der unvollständigen Vermischung von Luft und Brennstoff leider auch etwas CO bilden. Der Maximalwert für CO2 lässt sich so also in der Praxis nicht erreichen. Lieber akzeptiert man in der Praxis einen Luftüberschuss und damit einen Lambda-Wert größer 1, um auf diese Weise dem Manko der CO-Bildung durch immer mehr Sauerstoffüberschuss begegnen zu können. Auf diese Weise korrigiert man insgesamt die Abgasverluste nach unten. Man nimmt in Kauf, dass überschüssige Luft-, Stickstoff- und Sauerstoffmengen durch den Schornstein geblasen werden. Aber dafür wird der eingesetzte Brennstoff zu einem erheblichen Anteil komplett ausgenutzt.
Der springende Punkt ist aber:
Man erkauft sich den hohen Anteil der Verwandlung von Kohlenstoff zu Kohlendioxid durch immer mehr Abgasmenge insgesamt. Das bedeutet, dass prozentual der Anteil an CO2 im Abgas sogar sinkt, obwohl absolut mehr CO2 im Abgas enthalten ist. Auf Basis dieser Überlegungen erforschten die Hersteller von Wärmeerzeugern oder eben Brennern immer neue Techniken zur optimalen Verbrennung fossiler Brennstoffe. Heraus kamen zur Verbrennung von Erdgas die anspruchslosen atmosphärischen Brenner mit Rückstromsicherung. Daneben sind hervorragende aber technisch etwas aufwendigere Gebläsebrenner am Markt etabliert, die der Gemischaufbereitung ein ordentliches Gebläse spendiert haben. Diese kommen ohne Rückströmsicherung aus und pressen Abgase gewissermaßen gewaltsam nach draußen. Mittlerweile sind die sogenannten Vormischbrenner verbreitet. Sie arbeiten ebenso gebläseunterstützt und erreichen sehr hohe CO2-Gehalte im Abgas.
Die effiziente Verbrennung von Heizöl gestaltet sich ungleich schwieriger. Zurzeit ist noch der Zerstäuberbrenner der am häufigsten verwendete. Schwieriger ist die Verbrennung im Vergleich zum Erdgas, weil ja der Brennstoff Öl an sich erst einmal in die gasförmige Phase überführt werden muss, um überhaupt eine Neigung zu zeigen, sich mit Sauerstoff zu verbinden. Es ist so, dass nur gasförmige Stoffe in einer exothermen Reaktion verbrennen.

Bild: Christian Wyrwa
Messtechnische Erfassung
Die Abgas-Messgeräte im Kundendiensteinsatz unserer SHK-Branche erfassen diese Zusammenhänge. Das bedeutet, dass in diesen Geräten der Sauerstoffgehalt des Abgases gemessen und dann hochgerechnet wird. Das Messgerät schließt gewissermaßen vom Sauerstoffgehalt im Abgas auf den Kohlendioxidgehalt.
Erfahrene Kundendienstmonteure stellen den herstellerspezifischen Wert für eine optimale Verbrennung des jeweiligen Wärmeerzeugers ein. Sie wissen spätestens seit diesem Bericht, warum nicht ein theoretischer Maximalwert in Abhängigkeit von dem eingesetzten Brennstoff das Ziel einer Einstellung ist.
CO2max
Heizöl: 15,4 %
Erdgas: 11,9 %
Methan: 11,7 %
Flüssiggas: 13,9 %
Vielmehr muss die Art der Gemischaufbereitung des Brennstoffs und der Umgebungsluft berücksichtigt werden.
Jeder Hersteller von Wärmeerzeugern hat da seine eigenen Spitzenwerte.
Ein empfindlicher CO-Sensor eines Abgasmessgerätes gibt bei Bedarf Auskunft über den Anteil des schädlichen, weil giftigen Kohlenmonoxids. CO im Abgas ist natürlich auch ein Indiz für eine unvollständige Verbrennung.
Und der Wirkungsgrad?
Ziel der Einstellungen an einem Brenner ist es also, den herstellerspezifisch kleinsten Wert des Sauerstoffgehaltes und damit den höchsten Wert für CO2-Anteile im Abgas einzustellen. Das entspricht dann gleichzeitig dem kleinsten sicher erreichbaren Lambda-Wert für diese Feuerung. Das ist kein Selbstzweck, sondern stellt in der Regel die höchste feuerungstechnische Effizienz für diese Anlage dar.
Ein modernes Messgerät ermittelt aus diesen Messdaten dann die Abgasverluste der Anlage. Es fehlen allerdings noch die Temperaturen der Verbrennungsluft und des Abgases. Es versteht sich von selbst, dass mit Abgasen, die extrem heiß ins Freie geblasen werden, keine hohen Wirkungsgrade zu erzielen sind.
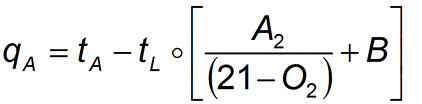

Formelkürzel:
tA: Abgas-Temperatur
tL: Verbrennungsluft-Temperatur
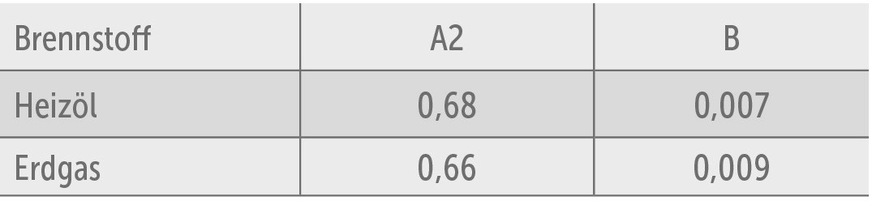
A2/B: brennstoffspezifische Faktoren (siehe Tabelle)
21: Sauerstoffgehalt der Luft
O2: gemessener O2-Wert
Tabelle der brennstoffspezifischen Faktoren (Auszug)

Überprüft man anhand dieser Formel den Zusammenhang von Sauerstoffgehalt im Abgas mit dem Wirkungsgrad, so zeigt sich bei ansonsten gleichen Temperaturverhältnissen die bereits beschriebene Abhängigkeit. Viel Sauerstoff im Abgas deutet auf eine weniger effiziente Verbrennung hin.
Beispiel für die Verbrennung von Erdgas
tA = 100
tL = 20
Variable Werte für den Anteil von Sauerstoff in
Messung 1: 15 % Sauerstoff
Messung 2: 12 % Sauerstoff
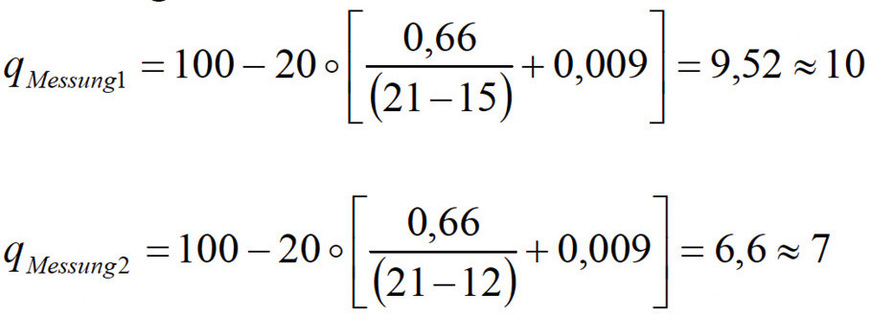

Der Abgasverlust für die erste Messung ergab einen Wert von rund 10 % und bei der zweiten Messung, mit weniger Luft als Ballast, ergaben sich nur noch 7 % Verluste.
Sie sehen abschließend also, die Zusammenhänge und Abhängigkeiten sind durchschaubar und können für zukünftige, exotherme Reaktionen mit entsprechend ausgeklügelten Lambda-Werten mit hoher Effizienz beeinflusst werden.
Bezug zu derzeitigen Diskussionen
Das bisher überwiegend verwendete Erdgas in Deutschland stammte aus Russland und hatte zufriedenstellenderweise eine sehr gleichmäßige Zusammensetzung. In der nächsten Zeit werden wir auch Brennstoffe einsetzen, die von dieser Gleichartigkeit abweichen.
Stellen Sie sich also vor was passiert, wenn ein Gebläsebrenner immer die gleiche Luftmenge im Brennraum zur Verfügung stellt, das Brenngas aber anders zusammengesetzt ist als ursprünglich angenommen …
Genau, dann passt im Zweifel der Lambda-Wert nicht mehr für eine effiziente Verbrennung. Denn sollten plötzlich mehr oder auch weniger Ärmchen nach diesem angebotenen Sauerstoff greifen als in der Ausgangslage mit russischem Erdgas, kippt die Voraussetzung für eine effiziente Verbrennung.
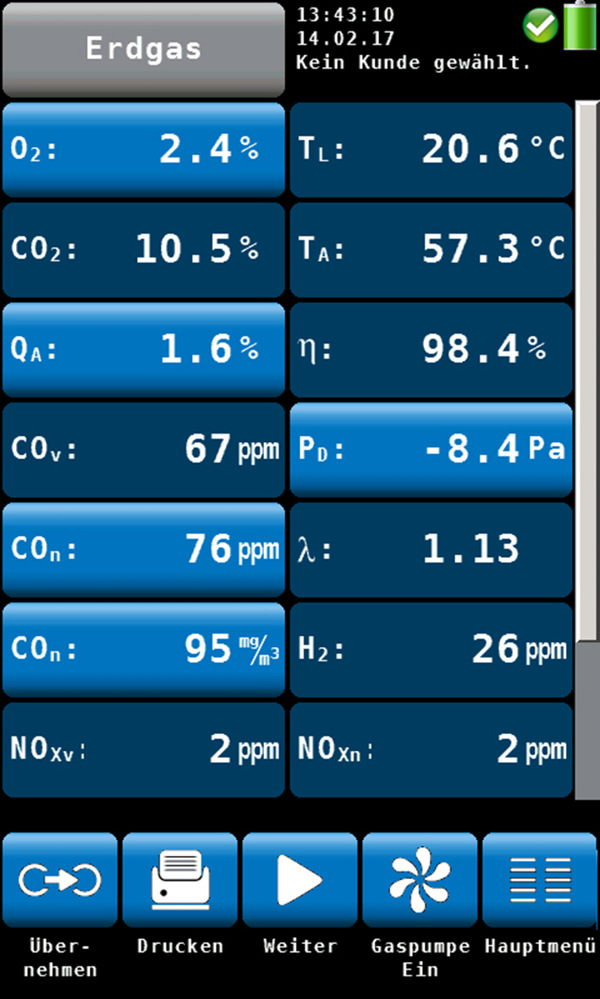
Bild: Wöhler

Bild: sharpner – stock.adobe.com
Lehrsatz zu Lambda
Das Verhältnis der überschüssigen Verbrennungsluft zum theoretischen Luftbedarf nennt man Luftzahl oder Luftverhältniszahl λ (Lambda).
FILM ZUM THEMA
Einen Film des Messgeräteherstellers Wöhler zur Abgasmessung gibt es hier:
https://www.youtube.com/watch?v=rIDwpwLwknQ
www.sbz-monteur.de ➔ Das Heft ➔ Filme zum Heft








