Auf erste Erfahrungen mit der allgemeinen Gasgleichung stößt man beispielsweise im Zusammenhang mit einem Luftballon. Schon geringe Kräfte, wie das Zusammendrücken, reichten als Kind aus, den Druck in einem aufgeblasenen Ballon zu erhöhen und seine Außenhaut letztlich strammer erscheinen zu lassen, bis diese Haut dann schließlich überdehnt wurde und der Ballon platzte. Die damalige Erkenntnis: Ich kann den Druck erhöhen, wenn ich das Volumen verkleinere.
Oder wenn in eine Papiertüte hineingeblasen wurde, erhöhte sich der Druck, sobald die Tüte gefüllt war. Die damalige Erkenntnis: Das Hinzufügen von Gasvolumen in einen geschlossenen Behälter erhöht den Druck.
Stand man unerlaubt und sehr nahe an einem offenen Lagerfeuer, so spürte man die aufsteigende Luft. Die Erkenntnis damals: Warme Luft steigt auf. Ganz clevere unter uns hätten in diesem Zusammenhang auf die Ausdehnung der Luft bei Temperaturerhöhung geschlossen, die zu diesem Effekt führte. Klar ist aber: Hätte man uns damals diese Phänomene beschreiben lassen, hätten wir auch einzelne Gasgleichungen entwickeln können und ganz sicher hätten wir irgendwann den großen Zusammenhang erkannt. Aber das haben dann doch wieder einige Kollegen erledigt. Wer zu spät kommt, den bestraft halt das Leben. Also, was haben andere für uns aufgeschrieben, was wir eigentlich auch schon wussten?

Bild: David De Lossy / thinkstock
Konsens bei der Gasgleichung
Unsere eigenen Erfahrungen und die einiger Wissenschaftler führen zu einer allgemein gültigen Formel über Gase
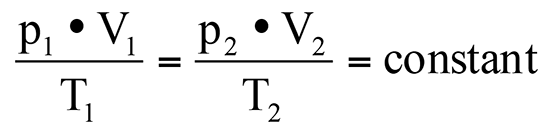
p = absoluter Druck in Pascal (Pa)
V = Volumen in Kubikmeter (m³)
T = absolute Temperatur in Kelvin (K)
Die tiefgestellte Zahl, der sogenannte Index, steht dann für die Situation im jeweiligen Zustand 1 oder eben 2.
Man muss dazu sagen, dass es sich um idealisierte Vorgänge in Gasen handelt, die dieser Formel zugrunde liegen. Aber immerhin fasst man so einige nachvollziehbare Alltagsgeschichten zusammen und erhält berechenbare Ergebnisse.
Mit der Ausdruck „Pehmalvaudurchte ist konstant“ kommt man durchs Leben, wenn man über Gase und deren Verhalten nachdenkt.
Teilt man diese Masterformel in kleine Bereiche auf, dann wird es noch übersichtlicher.
Man könnte also auf beiden Seiten der Gleichung jeweils den Druck „p“ das Volumen „V“ oder die Temperatur „T“ wegfallen lassen.
Im Prinzip bedeutet diese Reduktion der Formel, dass man den jeweils weggelassenen Zustand zur Situation 1 und 2 in beiden Fällen konstant hält.
Man betrachtet die Änderung eines Gases dann also bei konstantem Druck (p fällt weg), konstantem Volumen (V fällt weg) oder konstanter Temperatur (T fällt weg).
Konstanter Druck
Die erste hier beschriebene Zustandsänderung soll eine isobare Zustandsänderung sein. „Iso“ und „bar“ deutet schon darauf hin, dass der Druck unverändert bleibt. Die Formel für diesen Spezialfall lautet dann:
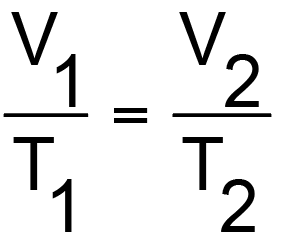
V = Volumen in Kubikmeter (m³)
T = absolute Temperatur in Kelvin (K)
Ein Beispiel erläutert die Zusammenhänge:
Die Luft von 20 °C (293 K) eines Wohnzimmers wird in dem dort betriebenen, offenen Kamin auf 250 °C (523 K) erwärmt. Auf welches Volumen vergrößert sich ein Kubikmeter dieser Raumluft?

Ein Kubikmeter bläht sich also auf 1,785 Kubikmeter auf.
In der Praxis erfährt jede Kaminfeuerung also eine isobare Zustandsänderung der beteiligten Gase. Dabei wird das Gas naturgemäß leichter als die Umgebungsluft. Und diese schwere Umgebungsluft drückt letztlich das leichte Abgas zum Schornstein hinaus. Wer will, der schaut sich dies Phänomen in einem manipulierten Bällebad an. Dort werden, als Manipulation, wassergefüllte und normale, hohle Bälle eingelassen und umgerührt. Sie können sicher sein, dass sich die wassergefüllten, schweren Bälle unten sammeln und dabei die hohlen, leichteren Bälle nach oben verdrängen. Ein Gedankenexperiment reicht hoffentlich, sonst wird es aufwendig.
Konstantes Volumen
Die Formel bei einem angenommenen konstanten Volumen lautet:
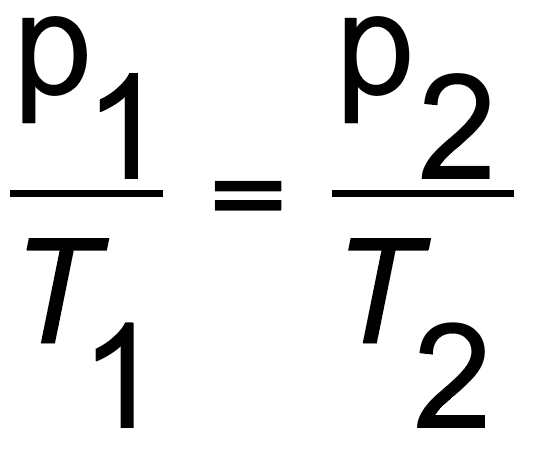
p = absoluter Druck in Pascal (Pa)
T = absolute Temperatur in Kelvin (K)
Ein Beispiel erläutert auch diese Zusammenhänge. Ein Gasvolumen in einem geschlossenen Rohrleitungsverlauf kühlt sich von 40 °C auf 10 °C ab. Der Ausgangsdruck in dieser Gasleitung betrug vor der Abkühlung genau 1 bar. Was verändert sich durch diese Abkühlung und welche Werte werden nach der Abkühlung genau erreicht?
p1 = 1 bar = 100 000 Pa
T1 = 40 °C = 313 K
p2 = ?
T1 = 10 °C = 283 K
Gedanklich kann man sich schon vorbereiten und abschätzen, dass die warmen und daher wild tanzenden Gasmoleküle durch die Abkühlung zur Ruhe kommen. Der Druck wird also nach der Abkühlung geringer sein. Um den rechnerischen Nachweis für diese Annahme zu führen, muss die Ausgangsformel umgestellt werden:

Die Annahme mit der Druckabnahme hat sich also bestätigt. Der Druck ist auf 90415 Pa abgesackt. Diese Zustandsänderung bei konstantem Volumen (die Rohrleitung hat sich nicht verändert) bezeichnet man als isochore Zustandsänderung. In der Praxis des Anlagenmechanikers findet diese Änderung immer wieder statt während der Dichtheitsprüfung von Gasleitungen. Nach dem Einfüllen des Prüfgases in eine Gasanlage erfolgt zunächst eine Temperaturanpassung des eingefüllten Gases. Meistens kühlt das eingefüllte Gas sich an den Rohrwandungen ab und der Druck sinkt in den ersten Minuten nach dem Einfüllen, obwohl die Gasleitung nicht zwingend undicht sein muss.
DICTIONARY
Naturwissenschaftler = natural scientist
Gasgesetz = ideal gas law
Gedankenexperiment = thought experiment
Zustandsänderung = change of status

Konstante Temperatur
Eine weitere Formel lautet schlicht:
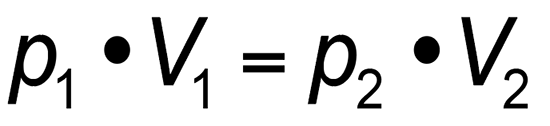
p = absoluter Druck in Pascal (Pa)
V = Volumen in Kubikmeter (m³)
Es handelt sich dabei um eine isotherme Zustandsänderung. Auch für diese Formel bringt ein Beispiel Licht ins Dunkle. Bei einem absoluten Druck von 2500 mbar wird ein Membranausdehnungsgefäß in Betrieb genommen Das Gasvolumen beträgt anfangs 5 Liter. Wasser strömt in das Gefäß und quetscht das Gasvolumen zusammen. Dabei verkleinert sich das Gasvolumen auf 4,5 Liter. Welcher Druck herrscht nach der Volumenänderung? Aus der praktischen Erfahrung weiß man, dass der Druck sich erheblich erhöhen wird:

Klar, der Druck steigt an, dafür ist das Gefäß ja schließlich gebaut worden. Übrigens ist der Temperaturunterschied des eigentlichen Luftpolsters insgesamt nicht relevant. Das Polster bleibt ja nicht auf Dauer einer hohen Wassertemperatur ausgesetzt. Vielmehr kühlt sich das Gefäß immer wieder und allmählich ab.
Alles Zusammen
Eine Luftpumpe soll betätigt werden.
Ursprünglich beträgt der absolute Druck in dem Kolben genau 1 bar, das Volumen genau 1 Liter und die Temperatur 10 °C , also 283 K.
Der Druck der Pumpe wird durch Einschieben des Kolbens erhöht und das Volumen dadurch gleichzeitig verringert. Am Schluss dieses Versuchs zeigt das Manometer 10 bar Überdruck, also 11 bar absolut und beinhaltet noch ein Volumen von 0,1 Liter. Welche Temperatur wird sich wohl einstellen?
Insgesamt darf man annehmen, dass es warm wird in diesem Kolben, aber schauen wir mal:
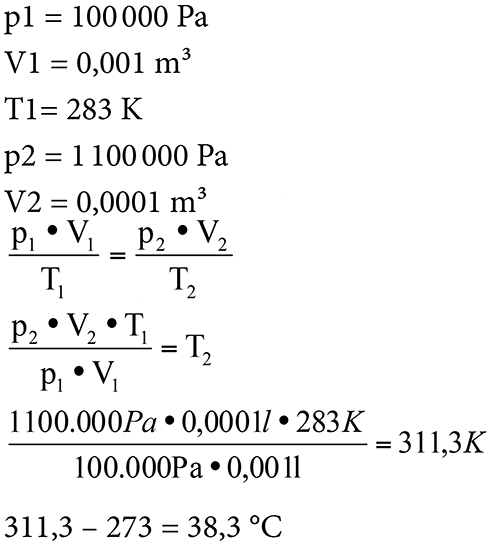
Unter diesen Umständen wird sich also eine Temperatur von 38,3 °C einstellen.
Fazit
Man kann tatsächlich feststellen, dass auch die Naturwissenschaftler nur mit Wasser kochten beziehungsweise ihre Voraussagen aufgrund von Erfahrungen formulierten. Könnten wir also allesamt kleine Einsteins sein? Eigentlich schon! Allerdings fehlt uns wohl der Mut, ein allgemeines Gesetz der Naturwissenschaft zu formulieren. Obwohl: Mir ist aufgefallen, dass sich viel mehr Drehkraft auf ein Stück Rohr aufbringen lässt, wenn ich ganz hinten statt ganz vorne an einer Rohrzange anfasse. Und mit der Halbzollzange geht weniger als mit der Anderthalbzollzange. Kann ich das auch als naturwissenschaftliches Gesetz formulieren?

Bild: Milan Vasicek / thinkstock








