Wie funktioniert eigentlich Enthärtung durch Ionenaustausch
.
„Tja, da wird wohl eine neue Waschmaschine fällig, diese hier ist jedenfalls völlig verkalkt“, sagt der erfahrene Mechaniker im Werbespot. Und das Mütterchen mit der gerunzelten Stirn schaut traurig durch die Kamera hinein in Deutschlands Wohnzimmer. Hätte man ihr helfen können?
.
.
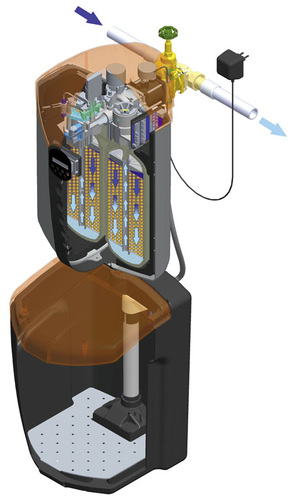
Tatsächlich sind die Regionen in Deutschland mit sehr unterschiedlichen Wasserqualitäten geschlagen. Und tatsächlich gibt es Regionen mit enorm hartem Wasser. Verantwortlich dafür sind die zwei Härtebildner. Jene, Calcium- und Magnesiumionen werden gegebenenfalls mit dem Frischwasser aus dem Versorgungsnetz in die Haushalte gepumpt. Mit zunehmender Frischwassertemperatur verringert sich dann die Lösemöglichkeit für diese Hardliner. In der Folge lagern sie sich ab. Bevorzugt befinden Sie sich dann an den warmen oder sogar heißen Stellen im Hause wieder. Diese Orte sind Trinkwassererwärmer, Kaffeemaschinen, Waschmaschinen (die dann mit enormen Trara in den Medien verschrottet werden) und alles was mit erwärmten Wasser in Berührung kommt. Hartes Wasser erschwert zudem noch die Reinigung von Geschirr im Geschirrspüler oder die Oberflächenreinigung von Duschkabinen. Grund genug, dem umgangssprachlichen Verkalken den Kampf anzusagen. Also raus mit dem Kalk.
.
Der Weg
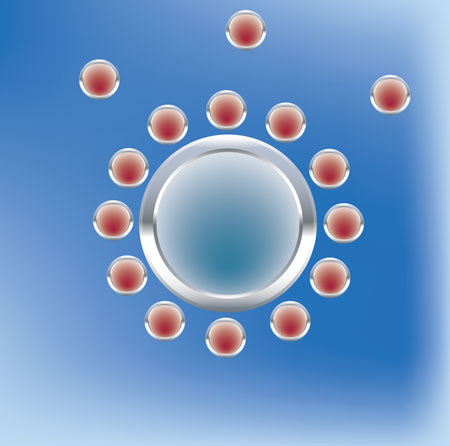
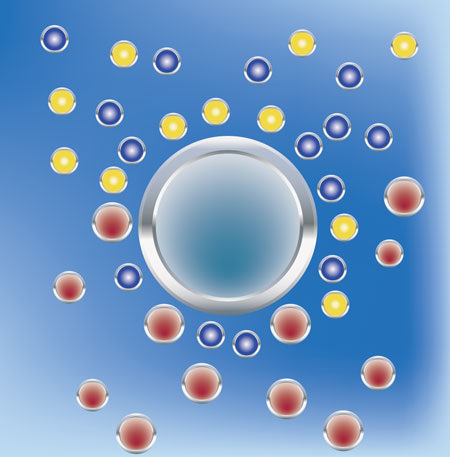
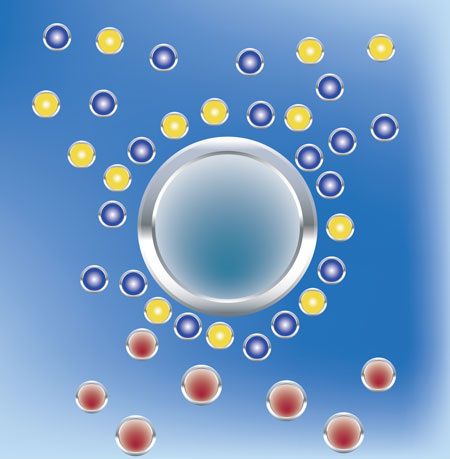
Bei der Wasserenthärtung werden Härtebildner wie Calcium und Magnesium im Tausch gegen leicht lösliche Salze, wie Natrium, herausgenommen. Das Wasser wird enthärtet, der Gesamtsalzgehalt und somit auch die elektrische Leitfähigkeit (auch Leitwert genannt) bleiben daher annähernd gleich. Nur dieses Natrium im Tausch gegen Calcium und/oder Magnesium wirkt eben nicht so störend. Man nennt den Vorgang, weil er im Stadium der Ionisierung abläuft, Ionenaustausch. Das Prinzip der Ionentauscher ist allgemein, dass einige Ionen stärker an den Ionenaustauscher gebunden werden als andere. Dabei werden höher geladene Teilchen stärker angezogen. Zum Beispiel wird Na+ im Ionentauscher durch Ca2+ verdrängt. Das stärkere Ion vertreibt also das schwächere Ion aus dem Ionentauscher. Das unerwünschte Ion, das aus der Lösung entfernt werden soll, wird also immer stärker angezogen als die im ungeladenen Zustand vorhandenen Ionen, die beim Austausch abgegeben werden. Damit kommt der Prozess natürlich irgendwann zum Erliegen. Wenn nämlich sämtliche NA+ durch CA2+ ersetzt sind, ist der Tauschhandel mangels Masse abgesagt. Jetzt greift man zu einem pfiffigen Trick. Man bietet dem Ionentauscher eine zahlenmäßig überlegene Anzahl von NA+-Ionen an und schnell wird die Neigung zurückzutauschen angeschubst. Diesmal werden, aufgrund der erhöhten Stoffkonzentration des Natriums, diese Ionen wieder Platz nehmen auf dem Tauscher und die eingelagerten CA2+-Ionen verjagen. Anfangs siegt also die Gier des einzelnen CA2+-Ions und der Härtebildner klammert sich an den Tauscher. Zur Regeneration des Tauschers schickt man anschließend eine zahlenmäßig überlegene Mannschaft Na+-Ionen auf das Spielfeld. Und mit dieser erhöhten Stoffkonzentration lagert sich dann wiederum Na+ auf die Tauscherfläche, bereit sich wieder tauschen zu lassen. Diesen Prozess bezeichnet man sinnigerweise als Beladung. Er muss stattfinden, wenn die Natrium-Konzentration erschöpft ist - klar. Eine Beladung (Regeneration) muss aber unabhängig davon aus hygienischen Gründen alle vier Tage erfolgen, also unabhängig davon ob es nötig ist oder nicht.
.
A
.
.
B
.
.
C
.
.
D
.
.
Das Spielfeld
Der Ionenaustausch benötigt viel Platz. Und diesen Platz bietet feinkörniges Granulat. Dieses Granulat wird auch als Ionenaustauscherharz bezeichnet. Das Bestreben der Hersteller dieser Harze ist es, möglichst viel Fläche für die jeweils zu tauschenden Ionen zu bieten. Wurden in der Vergangenheit noch natürlich vorkommende Stoffe wie beispielsweise Zeolith eingesetzt, werden heutzutage hochentwickelte Harze zweckoptimiert fabriziert. Diese Harze bieten pro Gramm gute 26 Quadratmeter Fläche (!). Das entspricht der Ausdehnung eines recht ordentlichen Wohnzimmers, pro Gramm wohl gemerkt. Das Geheimnis des Ionenaustausches steckt also auch in dem Aufbau dieser Körnchen mit einem Durchmesser von oft nur 0,2 mm.
.
Der Verschnitt
Nachdem das ehemals harte Wasser an den Körnchen vorbei zum Ausgang des Ionentauschers geströmt ist, kann es als Weichwasser bezeichnet werden. Eine solche extreme Weichheit wird aber meist nicht in das Trinkwassernetz des Hauses gegeben. Es wird eine akzeptabler Wert angestrebt der bei 8 ° deutscher Härte liegt. Dazu wird einfach Wasser an dem Ionentauscher vorbeigeführt. Es behält daher seine Härte und kann hinter dem Ionentauscher mit dem daraus gelieferten Weichwasser gemischt werden. Man nennt diesen Vorgang den Verschnitt. Man mischt hier quasi das Weich- und Hartwasser zu einem Wasser mit Härtegrad nach Wunsch. Bei der Technik der Enthärtung darf man eine wichtige Sache aber nie aus den Augen verlieren; und zwar die Grenzwerte der Trinkwasserverordnung. Denn beim Enthärtungsvorgang werden zwar Calcium und/oder Magnesium dem Wasser entzogen, dafür aber Natrium zugeführt. Dieser Tausch darf aber nie zur Folge haben, dass die Grenzwerte für Natrium, die in der Verordnung festgelegt sind, überschritten werden.
.
.






